作者/宏恩綜合醫院肝膽胃腸科 譚健民
引言
益生菌是由世界衛生組織定義為「在適量給與個體後,能具有促進人體健康益處的微生物」之謂也,亦即益生菌不會令人致病,並對人類有益的細菌。益生菌並不是一個新的名詞,早在一個多世紀之前,1907年由諾貝爾經濟學獎得主俄國微生物學家與免疫學家埃黎耶·埃黎赫·梅契尼可夫(Élie Metchnikoff)首先在保加利亞居民中,發現在其居民所攝取的發酵牛乳中含有「乳酸菌」,並得知這種乳酸菌可以抑制消化道內有害細菌,且與該居民普遍存有長壽現象有關,而由此宣稱乳酸菌具有裨益於人類健康及促進壽命延長的功效。事實上,益生菌在過去幾千年的日常生活健康食品中早已存在,即使在古希臘與羅馬帝國時代的乳酪及其相關發酵產品也已被極力推薦用於食用了。
此類細菌直到1965年才被DM Lilly 與RH Stillwe二位學者冠以「益生菌」(probiotics)的名稱,而益生菌的現代術語及其基本定義則由Parker於1974年所衍創出來的,並明確指出益生菌本身是一種具有產生有益物質的微生物,其可以調節並促進腸道中不同種微生物群的動態平衡,而由此來影響宿主各種生理活動。由於Élie Metchnikoff發現乳酸菌對人體的益處,而被人們尊稱為「乳酸菌之父」1。
近數十年以來,益生菌在正確名稱出現後,其在消費市場已逐漸盛行並由此源遠流長了。早在1930年,日本代田(Shirota) 已開始繁殖乾酪乳桿菌代田株(Lactobacillus casei strain Shirota),隨後並在1935年以養樂多(Yakult)的名稱引入市場,如今養樂多在全球33個國家及每天有30萬瓶的養樂多銷售在市場上。
腸道菌群(Gut Microflora)2
基本上,正常人體內的微生物群與宿主本身的組織、細胞及其代謝產物,在長期進化過程中形成一個獨立的環境,並建立一個生物系統(biosystem)以進行彼此相互交換物質、能量及基因的目的。人體微生態系統主要存在於口腔、呼吸道、胃腸道、泌尿道及皮膚等5大生態系統,而胃腸道系統又是其中人體微生態環境(ecosystem)中最重要的組成,而腸道菌群本身亦形成一個最大最複雜的微生態系統。胃腸道微生態環境分佈於食道、胃、小腸、大腸等中空器官,人類胃腸道內存有約萬億個(trillions)微生物,即約1014 個細菌及古細菌(archaea),其總重量約在1~2公斤之間(平均為1.3公斤),總數量亦超過人體細胞的10倍,可類別分為約104餘物種。
由於腸道蠕動較慢以及具有極低的氧化還原電位,使得大腸成為人類微生物定植的原發地帶,大腸也因而窩藏極大數目的細菌種類,其細菌可達50屬400~500種,其中99.9%皆屬於專性厭氧菌(obligate anaerobes),但大部分腸道菌群尚未被培養出來,更有許多菌群尚未被確認出來,其大部份是由擬桿菌(Bacteroidetes)與厚壁菌門(Firmicutes)兩大菌種所組成的。此外,不同部位的腸道其細菌數量及組合亦不一樣。菌數由胃臟開始存在,並逐步在空腸、迴腸及大腸中增加。腸道菌群本身的組合亦隨著年齡的增長,以及飲食結構的不同而有所改變。理論上,腸道菌群已被證實在腸道免疫系統形成中發揮其關鍵作用的角色,其亦可影響全身性免疫系統功能。細菌數量在小腸中比在大腸較低,而逐漸朝向胃腸道的上部而減小。胃腸微生物組合物是由宿主遺傳因素與環境因素來確定。環境因素包括出生時的分娩方式、個體的逐漸老化、抗生素治療與個人衛生狀況。腸道菌群本身具有促進胃腸蠕動、腸道免疫防禦、消化與代謝以及炎症與細胞增殖的作用。
事實上,腸道菌群包含有腸內土生土長及常駐的細菌,以及短暫外來逗留腸道的細菌。大部分細菌在腸道內會形成厭氧生物反應器(anaerobic bioreactor),以幫助難以消化的多醣類分解,同時亦會合成微量營養素,其中包括有維他命B群與短鏈脂肪酸,這些細菌的發酵產物又可提供個體每日所需能量的10%。
益生菌的特點3
基本上,益生菌所賦予對健康的好處是取決於細菌不同菌株的特異性,因此任何一種菌株亦無法提供所有對人體健康的好處,甚至是同一種物種的菌株也不盡相同。
有益於人體健康的益生菌,具有哪些特點呢?一、益生菌必須是完全明確的被鑒定其安全性以及可以分門別類的。二、益生菌必須是可以安全食用的,其亦是無致病性或不會攜帶耐藥基因的,以及不被腸黏膜所分解,或不會與膽汁酸發生接合作用(conjugation reaction)的。三、益生菌必須在通過胃腸道後亦依舊能活存在大腸內,其必須要能對胃酸與膽汁有足夠的耐受性。四、益生菌必須能安穩定植並依附著在大腸黏膜表面上(至少能短暫存活在大腸內)。五、益生菌必須被證明對人類健康有所禆益的;比方說,能產生抗菌性的活性物質以及有對抗致病菌的能力,甚至有對抗癌細胞的能力。六、最重要的是該益生菌已通過某一種動物研究的試驗。七、此外,益生菌在其加工過程以及儲存期間必須要處於很穩定的狀態4[m1] 。再者,腸道菌群具有多種重要的生理功能,其可產生維他命、分解膽汁酸、消化營養物質,並藉此發揮局部性與全身性免疫功能,並形成對抗病原體的固有重要的腸道屏障。
益生菌可能的作用機制5
益生菌對於個體所呈現作用的機制,大致上可歸類三大方面即微生物學、上皮細胞組織學以及免疫學來陳述。目前截止,益生菌本身真正的作用機制尚未不太十分清楚,但其可能的作用機制包括有:一、通過改變炎性細胞因子(inflammatory cytokine)以及下調促多種炎性細胞級聯反應(proinflammatory cascades),或誘發菌株本身特異性的免疫調節機制,來調節胃腸道特有的免疫反應。二、經由移動某些產氣及膽鹽分解菌株的位置,來抑制病原細菌黏附在大腸黏膜上的作用。三、正常人體腸道的環境需呈現酸性,才能刺激大腸蠕動以進行其排泄功能,益生菌經由大腸內養分的發酵酸化作用,以降低並維持腸道的酸性pH值,並由此改變細菌群落的組成。四、強化大腸上皮細胞固有的屏障功能,而腸道管壁本身固有的完整性是由潘氏細胞(Paneth cells)來維護,這是一種棲息在腸道黏膜表面上的分泌型上皮細胞,其主要是分泌高數量的防禦素(defensins),以及產生某些有抗微生物與抗生素功效的胜肽(peptides),由此抗菌物質來增強宿主的免疫力。五、誘導大腸上皮細胞的μ-opioid與大麻素(cannabinoid receptors)的作用,以降低內臟感覺過敏反應,來促進脊髓傳入神經交流以及應激反應6。六、促進營養作用,提供短鏈脂肪酸。
一、益生菌調節腸道菌群組成
首先,益生菌能夠調節腸道菌群的組成。由最近的研究中,得知益生菌如鼠李糖乳桿菌(Lactobacillus rhamnosus GG, LGG)或乾酪乳桿菌(Lactobacillus casei)可以通過減少致病細菌如梭菌(clostridium) 來調節過敏體質嬰兒的腸道菌群組合,同時在糞便中更證明這些益生菌可以增強或維持雙歧桿菌(bifidobacteria)在腸道內的濃度。這是通過腸腔的低pH環境以及與致病細菌相互競爭營養物質所致的結果。
由雙歧桿菌在腸道定植的研究中,亦指出益生菌也可與其他微生物在宿主上皮細胞的特異性受體來競爭並結合,從而防止潛在病原體對上皮細胞的入侵。另外,在人體與動物的臨床觀察中,雙歧桿菌與乳桿菌的服用治療可以在嬰兒期,來調節微生物群的組合,以及激發其他外來益生菌種類的生長。
調節益生菌定植可以防止有害病原體持續在腸道黏膜上生長,因而進一步促進免疫系統的作用。此外,某些益生菌可以產生抑制致病細菌生長的細菌素(bacteriocins),如通過嗜酸乳桿菌的La-14(Lactobacillus acidophilus La-14) 所產生的細菌素,可以抑制李斯特菌(Listeria monocytogenes)的生長,此與以抗分枝桿菌(mycobacterium)或其他益生菌物種以前的研究結果是一致的1。
再者,在肝硬化罹患者中亦發現其小腸內存有細菌異常定植的現象,其中至少有50%的存有小腸細菌過度生長(small intestinal bacteria overgrow,SIBO)現象,其主要的原因是低胃酸狀態(hypochlorhydria)、IgA分泌降低、腸道蠕動減少以及營養不良。在臨床上,藥物使用在肝硬化罹患者中,因增加小腸蠕動後,則亦會減少細菌過度生長。因此,得知肝臟與腸道菌群間的緊密關係,更加顯示腸道屏障作用在肝疾病及其併發症的致病機制中,亦扮演極為重要的角色。
二、腸道菌群與細菌移位(bacterial translocation)
細菌移位被定義為腸腔細菌遷移至腸系膜及其他腸外部位的淋巴結而謂之。最常見的細菌易位至腸系膜淋巴結有革蘭氏陰性的大腸桿菌(Escherichia coli)及克雷伯菌屬(Klebsiella spp)、腸球菌(Enterococci)以及其他鏈球菌屬(Streptococci species)。在動物研究中,細菌易位至腸系膜淋巴結發生率在肝硬化大鼠併發腹水者約為40%,而在自發性細菌性腹膜炎者中則可高達80%左右。
在肝硬化併發門脈高壓及腹水細菌培養為陰性者中,約有三分之一個案的腹水可以培養出細菌DNA來,而大腸桿菌是其中最常見被確認的細菌種類。在臨床上,細菌DNA陽性者中可以發現炎性細胞因子濃度有明顯增加現象;此外,其中內毒素血症(endotoxemia) 可導致門靜脈壓力及血液凝固的障礙,甚至誘導出食道靜脈曲張破裂出血的危象。
基本上,肝硬化的細菌移位的致病機制是十分複雜的。除了小腸細菌過度生長之外,肝硬化也會呈現出腸黏膜與腸道免疫功能的變化。一氧化氮(nitric oxide)有助於腸壁形態的變化,在培養腸上皮細胞的觀察中,其可擴張腸上皮細胞的緊密連接。這表示對抗細胞旁黏膜第一線裂口防衛損傷,而使得潛在細菌易位現象的增加。緊密連接下面細胞間隙的擴張,這是肝硬化罹患者對細胞旁黏膜吸收的第二道防禦。此外,在肝硬化罹患者中,亦發現毛細血管擴張壁增厚、固有層的水腫、纖維肌性增生、絨毛/隱窩比率減少以及小腸黏膜肌層增厚現象存在,這些都是在細菌易位作用中所扮演的角色,也因而導致腸道屏障固有功能的受損5。
三、腸道菌群與免疫系統7
理論上,人體胃腸道始終與其寄居共生菌或膳食中的種種抗原有著很緊密的接觸。免疫系統必須在各種不同正常共生菌與膳食抗原中,鑑識出那些特定而需要保護性免疫機制對抗的病原體,使機體與微生物能維持在一個動態平衡狀態中。基本上,胃腸道中寄居著幾個類型的腸道菌群,其中包括細菌、病毒、酵母菌以及原蟲等。共生細菌是腸道環境中最常見的微生物,有利於人類宿主;反之,致病菌的侵襲則會引起腸道病變如腸炎等8。
共生菌與病原菌之間有時候會呈現一種平衡狀況,即所謂的「共生」(symbiosis)。在其共生過程中,腸道菌群、腸上皮組織以及黏膜免疫系統之間的互動,使得所處局部甚至全身都在一個動態平衡之中。反之,共生菌與致病菌相互作用的改變,便會導致體內動態平衡的破壞;而者之間的動態失調也會引起腸道局部感染與炎症反應的合併症。此外,亦可導致其他系統如中樞神經系統及內分泌系統的病變9。
再者,由動物研究中亦顯示上皮內淋巴細胞數量的增加,會使得干擾素γ的增殖活性與能力明顯的受損,此與其細菌易位的現象增加有關。總之,導致細菌易位衍生的主要機制是由於細菌過度生長;而局部免疫反應在黏膜上的缺失,則取決於巨噬細胞本身的吞噬活性以及嗜中性粒細胞的減少,再加上腸道屏障滲透性的增加5。
四、腸道菌群與腸道屏障10
基本上,腸道菌群與腸道免疫系統之間的相互作用可以大致上分為三層。在第一層,面向腸腔的主要是黏液層,其可再分為兩個子層:外層子層密度比較小,由密集的腸道菌群所定殖,而內面的黏膜層則由對共同菌具有特異性高濃度殺菌性抗菌胜肽(bactericidal antimicrobial peptides, AMPs)以及分泌型IgA(secretory IgA, SIgA)所組成。也由於AMPs及SIgA的組合構造存在於內緻密層內,使得細菌無法滲透入腸壁內。因此,益生菌可在腸道上皮細胞附著以及形成屏壁作用,來與致病菌相互競爭。
總之,益生菌可以促進腸道上皮細胞間的緊密接合,以形成功能性腸道保護屏障,同時提高分泌防禦分子如黏蛋白,以降低被病源菌感染後炎性反應後果。
益生菌與消化系統疾病11,12
由近40-50年來的臨床實務經驗的探討及研究中,已很明確顯示「腸道菌群」在個體健康與疾病的成因中,亦會扮演著某些重要的角色。而益生菌本身在腸道內的微生物動態生態平衡中,亦會參與導致肝臟病變與其合併症的持續的進展。
基本上,在許多腸道的自體免疫疾病如潰瘍性大腸炎(ulcerative colitis)及克羅恩病(Crohn's disease)甚至其他疾病,其在開始所呈現的是以腸道症狀為主的腸道疾病表徴,而其他與腸道菌群有關的疾病亦包括有糖尿病、肥胖、多發性硬化症、憂鬱症與焦慮症。同時,腸道菌群與腸道的動態平衡,以及腸道益生菌本身的耐受性及與其他病原體發生的對抗,亦存有息息相關的相互關係5,6。
益生菌本身的效應具有其菌株依賴性,亦即不同的物種及菌株則有不一樣的生物效應。基本上,益生菌產品的臨床療效是由某些因素來決定的,其中包括有如劑量(即菌落形成單位數)、劑型種類、製劑方式、服用途徑(經口服用益生菌或是大腸內灌注益生菌)、生存能力(腸道外或腸道內),更重要的是益生菌的物種、菌株類別以及其本身的不同基因組合成分。此外,益生菌本身的生物效應範圍、持續生存穩定性以及貯存環境的條件也是很重要的考量依據。
目前,在臨床上已被推薦可使用益生菌的肝臟、胃腸疾病包括有急性感染性腹瀉、旅行者腹瀉、抗生素相關性腹瀉(antibiotic-associated diarrhea)、習慣性便祕、壞死性小腸炎、腸道發炎性疾病(inflammatory bowel disease)、激燥性腸道症候群(irritable bowel syndrome)、復發性艱難梭菌大腸炎(relapsing Clostridium difficile colitis)、急性胰臟炎、非酒精性脂肪性肝疾病(nonalcoholic fatty liver disease)甚至肝硬化,但並非所有這些適應症都具有令人信服的臨床數據來支持其成效。
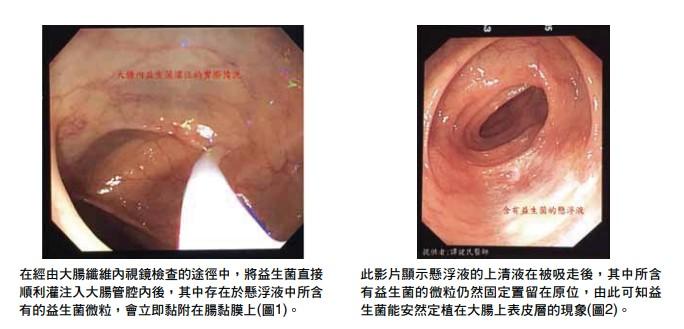
小腸細菌過度生長(small intestinal bacterial overgrowth, SIBO)給與「經胃鏡小腸內灌注益生菌」的輔助治療。
事實上,在臨床實務上可以經由「大腸內灌注益生菌」的步驟以避免益生菌因經由口服方式的途徑,而受到胃臟內強酸以及小腸內鹼性膽鹽及胰液等消化液的破壞,而無法達成全數移植到大腸黏膜上的目的(圖1,2)。
胃幽門螺旋桿菌本身屬於耐酸乳酸桿菌屬(acid tolerant lactobacilli),而由最近的研究亦指出,在胃幽門螺旋桿菌根除的標準三合一療法中,若再添加益生菌的補助給與,發現可以顯著提升治療功效、明顯降低治療的不良反應以及緩解潛在疾病的症狀與表現13。
基本上,個體腸道屏障的受損、腸黏膜通透性的增加、微生物生態環境的失調(dysbiosis)以及小腸細菌過度生長,在非酒精性脂肪性肝疾病的致病機制與發展上,皆扮演著舉足輕重的角色。基本上,肝臟與腸道之間有很強烈所謂的腸-肝軸(gut-liver axis)的關係。腸道血液供應到門靜脈系統,而腸道血液中所含的特殊物質會進一步啟動肝臟細胞的生理功能。此外,肝臟所分泌的膽汁亦會影響腸道功能。因此,在腸道內的微生物本身的生態環境中,腸道菌群或其代謝產物亦會經由門靜脈進入肝臟,並進一步影響肝臟本身固有的生理功能,即所謂的腸-肝軸理論15。
腸道菌群本身微生物生態環境的失調,亦間接受到腸道菌群本身定性及定量,與其代謝活性的異常變化的影響,亦受到菌群在腸道內分佈的部位的不同而有所變動。此時益生菌在腸道菌群數量上所佔的優勢,也就扮演著更重要的角色了14。
由目前研究證據顯示,益生菌對於降低抗生素引起腹瀉的發生率及降低感染性腹瀉的嚴重度,及其罹病期間具有明顯的臨床上的療效,其證據等級亦最佳;而益生菌對於降低激燥性腸道症候群病患腹部疼痛的嚴重度、腹脹感及降低高危險群嬰兒(risk-infants) 的異位性皮膚炎發生率及治療症狀,其證據等級則次之。此外,某些研究發現對於陰道念珠菌感染(vaginal candidiasis)、胃幽門螺旋桿菌(Helicobacter pylori)、腸道發炎性疾病(inflammatory bowel disease)及上呼吸道感染等,益生菌也呈現其其治療上的實質意義,但是實證分析則顯得證據有點不足16。此外,在某些研究中亦證實在激燥性腸道症候群罹患者中,其腸道內的乳桿菌與雙歧桿菌數量會減少,而厭氧菌如鏈球菌與大腸桿菌則增加,甚至厚壁菌門或類桿菌與梭菌的比值會增加,如此在在都告訴我們益生菌正扮演著極為重要的角色。
由近20~30年來的臨床研究顯示,腸道菌群與各種相關人類疾病如代謝症候群、過敏性疾病以及胃腸道與肝疾病亦有著密切的因果關係。
最近,經由基因組分析(genomic analyses)方法來分析腸道菌群種類,已全面鑑定出正常人口群與胃腸道疾病中的腸道菌群的各別種群分類,更進一步得知菌群本身或其不同組合在不同胃腸道疾病的形成中,的確扮演著其病理生理機制的角色。
人體為何需要再額外補充益生菌?
因為,下列因素會改變正常腸道菌群的功能與動態平衡:一、改變飲食結構會導致腸道內出現過多的發酵現象。二、減少益生元(prebiotics)在腸道中的儲存量,會導致雙歧桿菌數量的減少。三、不當抗生素的服用會改變腸道菌群的生態環境平衡。四、感染困難梭狀芽孢桿菌或大腸桿菌,會改變乳酸菌與雙歧桿菌的總數量。五、由於個體本身的老化,腸道內會逐漸降低固有厭氧細菌的數量,尤其是雙歧桿菌(Bifidobacteria),並因而增加其他腸桿菌科(Enterobacteriaceae)細菌與梭狀芽胞桿菌的數量。
此外,益生菌能促進維他命B群、維他命K以及某些消化酵素的產生,並產生抗菌物質,以增強宿主免疫力,這些都是益生菌最為實際的固有功能。大腸細菌菌群的組成似乎會因老化(年齡>60歲) 而改變,目前尚不太清楚老年人或許應比年輕人有不同劑量的益生菌來對待。
益生菌食品的迷思17,18
市面上,所販賣含有益生菌的食品或飲料,並沒有名文規定要其明示其中所含益生菌數量,或者應不能少於多少量才是適當的;此外,人體臨床使用劑量是根據動物研究實驗的結果,因此用於遞送各種菌株菌落形成單位(colony-forming unit,菌落形成單位,CFUs)的最佳數目仍然不很明確,而市售益生菌製劑通常具有至少在106-1012 CFUs/毫克之間。此外,業者亦不會也不能強調其中益生菌對某些疾病上有任何療效的因果關係,免得消費者把「益生菌」當作是一種藥物治療,而忽略本身潛在未經確診的疾病。一般個體在初期服用益生菌或大腸內灌注益生菌(intracolonic instillation of probiotics)時,也要特別注意其中益生菌保存的有限日期。某些個體如免疫力低下者、癌症病患正接受化療藥物者、因某些疾病大腸被切除過多者以及有心臟瓣膜心臟疾病或正接受心瓣膜移植手術者,這些個體在服用益生菌後,或許會衍生不可預期的不良反應,這些個體最好不要貿然服用益生菌;此外,民眾在服用各類益生菌前,亦應先諮詢你的主治醫師,先一番討論才來決定。
益生菌應在何時服用比較適宜?
以一般人想法而言,個體本身在空腹時其胃酸存量必然比較少,或許此刻服用益生菌亦比較不會被胃酸破壞,但某些「胃食道逆流疾病」罹患者其絕大部份處於「高胃酸」狀態,此類人口群在空腹時其所殘留的胃酸亦比較多,可想而知益生菌在此刻空腹時服用亦較易被破壞。
再者,個體在空腹時其胃液pH值約在0.8-2之間,而在如此高酸環境中,不難可以將益生菌全數殺滅的。反之,在個體進食時胃壁細胞亦會被刺激而大量分泌胃酸出來,但由於食物本身即扮演著緩衝稀釋胃酸的角色,其中真正胃酸含量並不會太高(大約在pH 4-7之間),因此在餐間或隨餐服用(along with foods)益生菌亦不會有礙事。
反之,在個體進食時胃壁細胞亦會被刺激而大量分泌胃酸,但由於食物本身即扮演著緩衝稀釋胃酸的角色,其中真正的胃酸含量並不會太高,因此在餐間或隨餐服用(along with foods)益生菌亦不會有礙事。此外,約有半數的人並不習慣在空腹時服用某些藥物,因其易產生腸胃不適。
此外,約有半數的人並不習慣在空腹時服用某些藥物,因其易產生胃腸不適。由生理學的研究,益生菌在pH 1.5~3.0的胃酸環境中,其存活期不到三小時,而在pH 1.0的胃酸環境中逗留一個小時,則會完全被殲滅。再者,益生菌在濃度1.5% 的膽汁中,其存活時間亦不到三小時19。
由此看來,最適合吃益生菌的時間應是在餐間服用、隨餐服用,或餐後立即服用,此段時刻既沒有胃酸分泌導致太多的問題,也不會有空腹服用時的不適感,而益生菌更不易被胃酸破壞;此外,益生菌亦儘量避免與熱食混合服用。
事實上,益生菌在經由口服途徑進入胃腸道後,其難免亦會受到胃內強酸以及小腸內鹼性膽鹽及胰液消化液的破壞,而僅有20~40%的益生菌能夠安然移植到大腸黏膜上,因此近些年來亦有些胃腸專科醫師會在施行大腸纖維內視鏡之便,將益生菌順便灌注入大腸內之舉,以達成益生菌全數移植到大腸黏膜上的目的。
結語及未來展望20
雖然在臨床上益生菌本身的效益機制並不十分完全瞭解。然而,以下則有四大主要被臨床醫師所認同的臨床效益:一、抑制病原菌的生長,使其無法進一步與上皮細胞接合,由此降低其侵入腸黏膜的機會。二、改善大腸黏膜屏障的固有功能。三、促進免疫系統的調適如保護性細胞因子(白細胞介素[interleukin], IL-10)的誘導及TGF-β與抑制促炎細胞因子如TNF,甚至抑制輔助T細胞(helper T cell) 的遷移。四、通過誘導微類鴉片及大麻素受體的表達,來調製腸道痛知覺的閥值增益(threshold gain) 。
基本上,如今民眾樂於服用益生菌,已成為已開發國家飲食中,越來越重要的食物組成部分之一。在臨床實務經驗上,益生菌對於胃腸道本身固有生理功能維護的影響,也受到大部分臨床醫師的認同。關於使用在胃腸道疾病中,益生菌仍有許多問題有待今後研究的釐清,其中包括有益生菌最理想的劑量及治療持續的時間;而特定益生菌在特定疾病狀態的明確的生理及免疫效應以及體弱者服用益生菌的安全性,亦有待將來更多的臨床實務經驗的進一步探討。
因此,益生菌有必要在市場上得到一個營銷制度的協調、規範功能性食品對人體健康的聲明、評估益生菌的功效以及益生菌的再定義;此外,嚴格規範哪些是或不是益生菌?益生菌基本療效的劑量是如何?何種是最佳的個別物種或品系?是否應單獨使用或組合使用?其劑量為何?以及益生菌本身的存活期?益生菌是否是絕對安全無害的?仍然不甚明確,畢竟「安全使用」益生菌絕對是一個臨床實務關鍵問題所在。
參考文獻:
1.Sekirov I, Russell SL, Antunes LC, et al: Gut microbiota in health and disease. Physiol Rev 2010; 90: 859–904.
2.Doré J, Corthier G: The human intestinal microbiota. Gastroentérol Clin Biol 2010: 34: S7–S15.
3.Lankaputhra WEV: Survival of Lactobacillus acidophilus and Bifidobacterium ssp. in the presence of acid and bile salts. Cult Dairy Prod J 1995; 30: 2–7.
4.Shanahan F, Collins SM: Pharmabiotic manipulation of the microbiota in gastrointestinal disorders, from rationale to reality. Gastroenterol Clin North Am 2010; 39: 721–26.
5.Ng SC, Hart AL, Kamm MA, et al: Mechanisms of action of probiotics: recent advances. Inflamm Bowel Dis 2009; 15:300–10.
6.Rousseaux C, Thuru X, Gelot A, et al: Lactobacillus acidophilus modulates intestinal pain and induces opioid and cannabinoid receptors. Nat Med 2007; 13: 35–7.
7.Kau AL, Ahern PP, Griffin NW, et al: Human nutrition, the gut microbiome and the immune system. Nature 2011; 474:327–36.
8.Hwang EN, Kang SM, Kim MJ, Lee JW: Screening of Immune-Active Lactic Acid Bacteria. Korean J Food Sci Anim Resour 2015; 35(4): 541-50.
9.Macpherson AJ, Harris NL: Interactions between commensal intestinal bacteria and the immune system. Nat Rev Immunol 2004; 4: 478–485.
10.Madsen KL: Interactions between microbes and the gut epithelium. J Clin Gastroenterol 2011; 45(Suppl): S111–114.
11.Besselink MG, van Santvoort HC, Buskens E, et al: Probiotic prophylaxis in predicted severe acute pancreatitis: a randomised, double-blind, placebo-controlled trial Lancet 2008; 371: 651–659.
12.Boyle RJ, Robins-Browne RM, Tang ML: Probiotic use in clinical practice: what are the risks? Am J Clin Nutr 2006; 83: 1256–1264.
13.Goran H, Nermin S, Karina V, et al: Probiotics for Standard Triple Helicobacter pylori Eradication A Randomized, Double-blind, Placebo-controlled Trial. Medicine (Baltimore) 2015; 94(17): e685.
14.Clarke G, Cryan JF, Dinan TG, ei al: Review article: probiotics for the treatment of irritable bowel syndrome - focus on lactic acid bacteria. Aliment Pharmacol Ther 2012; 35(4): 403-13.
15.Moraes-Filho JP, Quigley EM: The intestinal microbiota and the role of probiotics in irritable bowel syndrome: a review. Arq Gastroenterol 2015; 52(4):331-8.
16.Williams MD, Ha CY, Ciorba MA: Probiotics as therapy in gastroenterology: a study of physician opinions and recommendations. J Clin Gastroenterol 2010; 44:631–636.
17.Bajaj JS, Saeian K, Christensen KM, et al: Probiotic yogurt for the treatment of minimal hepatic encephalopathy. Am J Gastroenterol 2008; 103: 1707–1715.
18.Hempel S, Newberry S. Ruelaz A, et al: Services USDoHaH. Safety of Probiotics to Reduce Risk and Prevent or Treat Disease. 2011.
19.Snydman DR: The safety of probiotics. Clin Infect Dis 2008; 46(Suppl 2): S104–111.
20.Shanahan F: Probiotics in perspective. Gastroenterology 2010; 139: 1808–1812.