作者/1宏恩綜合醫院胃腸肝膽科 2麻醉科 譚健民1 陳臺森2柯雅欽2張婉芬2 文章出處/本文摘錄自《台北市醫師公會會刊》第63卷第5期
前言
基本上,腸道菌群在人類健康上的效益已受到為數不少的臨床醫師的關注,由眾多的臨床研究文獻報導也已証明腸道菌群對於維護人體健康有著深遠的影響。2001年聯合國糧農組織及世界衛生組織特別將「益生菌」定義為:『所謂「益生菌」是指在一定適量菌株之下,能夠對人體產生有益健康效應的「活生生的微生物」而謂之』。換言之,益生菌不僅是一種活生生的微生物,但必需要在擁有一定足夠適量的菌數之下,才會對人體腸道健康產生健康效應的1。
理論上,正常人類腸道有三大類腸道菌群,其中包括有益菌(即益生菌)、有害菌(即病原菌)以及伺機性病原菌(即條件性致病原菌)。在臨床實務經驗上,某些特定益生菌菌株已被証實對人類生理功能擁有某些程度健康的益處,而一旦腸道菌群發生生態失調(dysbiosis)時,也唯有益生菌的攝取,才能扮演好矯正腸道菌群生態失調的重要角色。
事實上,不只好菌與壞菌都會為了自身能夠在腸道中生存而互相競爭,亦即好菌不僅只是為了要抑制壞菌附著在腸管黏膜上,而不同好菌之間也會為了生存而互相排斥;換言之,在益生菌的攝取上不是攝取越多菌株屬種,才會對宿主健康影響更有所禆益的。此外,益生菌本身還具有某些不可或缺的代謝功能,如作為必需營養素及維他命的來源、幫助從食物中萃取能量與營養如短鏈脂肪酸(short-chain fatty acids, SCFAs) 以及氨基酸2。
益生菌、病原菌與伺機性菌的互動關係
平時一般伺機性菌對人體宿主健康是無害的菌種,但一旦個體本身出現嚴重營養不良、或免疫抵抗力降低,甚至體內腸道菌群生態環境出現失衡現象時,這些伺機性菌就會因而轉換成為有害的病原菌,並進一步危及宿主的健康。
根據細菌生理學的研究,大約有100萬億(100 trillions)細菌生活在人類的身體內部尤其是腸道內,而益生菌中的乳酸桿菌屬及雙歧桿菌屬就佔據了人類腸道菌群的90%之間,而其他病原菌如沙門氏桿菌、葡萄球菌、病原性大腸桿菌以及腸球菌等的總比率則不到10%。理論上,健康人的腸道不同菌群是按著一定比例存在的,也由於如此才能維持菌群固有的動態平衡。換言之,腸道內益生菌菌株數必需要佔有絕對大多數的優勢,才能使有害菌處於被壓制的狀態。因此,為了讓身體能處於最佳的健康狀態,則腸道菌群中的好菌與壞菌的黃金比率,應為好菌佔有85%,而壞菌則僅佔15%(或約6:1),而唯有在此比例之下,益生菌才能有足夠數量來抵制病原菌,而進一步保護人類腸道健康。此外,由於益生菌必需要全數黏附著在大腸黏膜表面上,才能夠發揮其特有的生理功能,不僅能與病原菌相互競爭腸內的養分,並抑制病原菌在大腸黏膜上著床接受體的黏附力;此外,益生菌本身亦會產生抗菌素(bacteriocin)來殺滅病原菌,甚至益生菌可刺激黏膜上一系列細胞因子的下調影響,來達到激發局部黏膜的免疫功能作用,以至於增強及促進宿主固有的免疫力功效3。
近些年來,由於DNA 測序技術(DNA sequencing techniques) 的介入發展,如最被常用的腸道菌群16S rRNA 的測序(Sequencing of 16S rRNA) 試驗,也明確的顯現出腸道菌群本身的複雜性及多樣性功能。由此得知,腸道菌群組成的變異所導致腸道菌群的失調,不僅與某些常見胃腸疾病有關,而腸道菌群生態失調在多種胃腸道外器官的致病機制中更扮演著極為重要的角色,如今最常被涉及到的議題包括有腸-肝軸、腸-腦軸、腸-腎軸、腸-皮膚軸甚至腸-代謝軸等的致病機制有所關聯。
益生菌的基本特徵
一、益生菌必須是完全明確的被鑒定其安全性以及可以分門別類的菌株,並與人類胃腸道菌群存有同源性的屬種。二、益生菌必須是安全而可食用,不具致病性及無毒性,其亦是無致病性或攜帶耐藥基因者,以及不被腸黏膜液所分解,或不會與膽汁酸發生接合反應的。三、能夠安然順利黏附在腸道上皮細胞上,並能夠在大腸(盲腸)及小腸(廻腸)內腔內定居、繁殖、生長與發育。四、益生菌必須被證明對人類健康有所禆益的;比方說,能產生抗菌性的活性物質以及有對抗病原菌的能力,最重要的是該益生菌已通過動物研究試驗,能與宿主保持良好的互動、互利及互惠關係。五、能夠利用宿主營養,而得以生存下來。六、在製作加工、儲存以及運輸過程中,益生菌不僅能保持其良好的活力,也能維持所需的生理穩定性。七、益生菌本身有抗炎反應、抗癌誘變以及對宿主免疫系統有刺激及調節的功能4。
益生菌作用的可能機制
目前來說,益生菌本身真正的作用機制尚未十分清楚,其可能的作用機制包括有:一、經由刺激免疫球蛋白A(IgA)的產生、促進抗炎細胞因子及其下調以及誘導調節性T細胞的作用,來促進宿主固有免疫反應的發育與進展;二、經由移動某些產氣及膽鹽分解菌株的位置,來抑制病原菌黏附在大腸黏膜上的細菌群落組成;四、強化大腸上皮細胞固有的屏障功能,而腸道管壁本身固有的完整性是由潘氏细胞(Paneth cell)的分泌型上皮細胞,其主要是分泌高濃度的防禦素(defensins)以及產生某些有抗微生物與抗生素功效的胜肽(peptides)。五、誘導大腸上皮細胞μ-opioid與大麻素接受器(cannabinoid receptors)的作用功能,並經由降低內臟感覺過敏反應,來促進脊髓傳入神經交流以及應激反應;六、促進宿主代謝作用的熱量回收,即產生短鏈脂肪酸如lactate(乳酸鹽)、acetate(乙酸鹽)、propionate(丙酸鹽)及butyrate(丁酸鹽) ,並產生精氨酸(arginine)與谷氨酰胺(glutamine)、合成維他命K與葉酸、參與藥物代謝如磺胺藥(sulfasalazine)來激活氨基水楊酸(5-aminosalicylic acid) 、促進膽汁酸的分解作用以及縮短食物在胃腸道的停留時間(transit time)。
總而言之,益生菌本身的主要作用機制包括鞏固及維護腸壁上皮固有屏障功能,以增加益生菌對腸黏膜的黏附性以及抑制病原菌腸黏膜黏附的作用,同時亦會產生抗微生物物質,以阻礙並排除病原菌的生存,同時牽動並操縱基因與啟動基因的調控,經由操縱與啟動基因調控,來調節免疫系統的運作,可以促進宿主體內免疫調節作用的平衡功能,而由此達到預防細胞凋亡的最終目的。
外源性益生菌製劑知多少
在服用益生菌之前,應該對其所選擇的益生菌,必需要考量的幾個常被大家所忽略的指標,其中包括益生菌菌株的選擇(益生菌菌株的種類及數量) 、添加物(或賦形劑)的成份內容以及益生菌在製造過程中的殘餘率(存活率)。基本上,腸道菌群菌數目是數以億萬計的,而益生菌在口服之前,或許其中益生菌本身的存活率已經很低了,因此口服有效益生菌的活菌率可能僅在5-20%之間不等5。
由於在實際益生菌的培育過程、包裝過程、上架期限、運輸過程,或是遭遇到生存環境中某些無法抗拒的逆境,使得益生菌在量與質的考量之下(益生菌與病原菌兩者有效的黃金比例為6:1),不僅無法使得益生菌能夠順利安然黏附在大腸黏膜上,更甭談益生菌可以駕馭及抑制伺機性菌甚至病源菌的生存6。
基本上,個體所攝取益生菌的存活菌數量太小,則對健康益處並無法起得上作用的。目前在坊間所販售含有益生菌的商品中,絕大部份被衛生單位歸類於食品類來販售,但商品內容的添加物更是琳琅滿目不勝枚舉的。食品益生菌不會就以其中的益生菌含量來做一個確認說明,因為衛生食品主管單就食品益生菌而言,也就僅止於設定其為健康食品來販售,因此不需要就其中益生菌數量做一個確認的要求說明,更何況製造商也不能過度強調其所含的益生菌能提供某些特殊疾病的療效7。
基本上,在細菌生理學研究探討中,指出益生菌在pH 1.5-3.0的胃酸環境中,其存活期不到三小時,而在pH 1.0的胃酸環境中逗留不到一個小時即會完全被殲滅。再者,益生菌在濃度1.5%的膽汁中,其存活時間亦不到三小時。事實上,益生菌在經由口服途徑進入胃腸道後,亦只僅有20-40%的益生菌能夠安然移植到大腸黏膜上,而得以成功定植在大腸黏膜上的或然率也只僅於5-10%之間不等。
一般人都是以口服的方式來攝取益生菌的,而一旦益生菌進入胃腸道時,其首先必然會先接觸胃臟所分泌的低pH酸鹼度(強酸)的胃酸以及總膽管所分泌出來的膽汁酸以及胰臟所分泌的胰液,而經過十二指腸後又可能會再遭遇到小腸液(弱鹼性pH7.6-8.0,小腸液每日分泌量在1-3公升不等)的衝擊與破壞,這些也是影響益生菌生長與繁殖穩定的眾多因素8,9。
此外,雖然益生菌是行簡單的無性分裂生殖,其本身繁殖能力很強,但一旦益生菌能夠順利進入迴腸及盲腸後,其所面臨的又是如何能長期存活及逗留在腸管內相關適宜的「養菌」環境,此時就要考慮宿主腸管內氧氣濃度、溼度、溫度、養份甚至酸鹼值等客觀條件,也唯有如此益生菌才能生生不息的存活在宿主腸道內。
基本上,獲得臨床效果所需的益生菌的菌株濃度通常在小腸中為106菌落形成單位/毫升(CFU/ml),在大腸中則為108 菌落形成單位/公克(CFU/g)。近些年來,生物科技產業製作中,已發展出微囊化方法(process of microencapsulation)用於提升以益生菌做為發酵食品與飲料中益生菌的存活率,但可惜的是口服益生菌畢竟還是要先面對它的天敵如胃酸與膽汁酸的攻擊。某些益生菌產品中有加添抗氧化劑,其可用於對抗因氧氣過多,而傷害益生菌生存的機會。此外,亦有些製造業者以噴霧乾燥或凍晶乾燥(live freeze-dried),再加上輕度熱處理,無非是為了降低益生菌的受損率,並由此增加益生菌在儲存過程中的存活率10,11。
攝取外源性益生菌的時機
目前而言,在臨床上有兩種攝取益生菌的方式,一是單純的經由口服途徑吞食攝取;二是經由在胃或大腸纖維內視鏡檢查途徑中,來順勢給與胃腸內益生菌灌注。
大多數民眾都會有一致性的問題:「口服益生菌在什麼時機服用比較適宜?」。基本上,由實證醫學的研究指出,不論益生菌本身製劑方式如何嚴謹並宣稱其較為抗酸或耐酸者,但其到達大腸盲腸的成功率僅在10-20%之間,而能達成着床黏附著在腸壁管黏膜上的或然率也僅不到5%。理論上,益生菌最好不要在「飯前或睡前空腹服用」(空腹時胃酸pH在0.8-2.0),最佳服用的時機則為「隨餐服用」(把益生菌當做一種餐間佳肴)、「餐中服用」(吃飯進行中服用)或是「飯後立即服用」(此時胃酸pH在4-6之間),因為此時此刻口服益生菌受到胃酸的傷害最少。反之,胃腸內灌注益生菌則可在定點定處,全數將益生菌安然移植到小腸/空腸與迴腸/盲腸的主要繁殖生長地方。因此,唯有胃腸內灌注益生菌的給與途徑方式,才能在一時間攝取人體所需要的足量益生菌。
胃腸內灌注治療的理論基礎
近年來,有些胃腸科專科醫師經由在大腸纖維內視鏡檢查過程中,將健康者的糞水直接灌注入結腸近端如盲腸或升結腸處,使得糞水中生存的腸道菌株能安然穩定的移植在大腸黏膜上,而謂之糞菌移植(fecal microbiota transplantation, FMT)治療,其最常被利用於困難梭狀芽孢桿菌(Clostridium difficile)感染個案的治療12。
此外,在臨床實務經驗上可以經由身體人工造口處或鼻胃空腸管來灌食或灌注藥物,其中包括有鼻胃管餵食(nasogastric feeding tube)、鼻空腸管餵食(nasojejunal feeding tube)、胃造口餵食(gastrostomy feeding)、胃管餵食(gastric feeding tube)、胃空腸管餵食 (gastrojejunal feeding tube)、空腸管餵食(jejunal feeding tube) 。根據以上實務醫學的作業經驗,此時此刻「大腸內灌注益生菌」的理論基礎儼然而生。
胃腸內順勢灌注益生菌的適應症
在臨床上,所謂「順勢」是指醫師在實施胃腸內視鏡檢查的過程中,端視當時胃腸内腔的實際情況,以及受檢者原有的胃腸道疾病,來決定適時在十二指腸、空腸以及大腸盲腸內給與益生菌灌注的步驟。在過去五年多的臨床實務經驗中,「宏恩綜合醫院無痛麻醉胃腸內視鏡早期胃腸癌瘤篩檢團隊」已克服一些技術上的問題,並秉持實證醫學的臨床實驗佐證,建置出一個完整操作「胃腸內灌注益生菌」輔助治療技術與步驟的標準作業流程,並成為國內首度將醫藥級益生菌順勢灌注進入胃腸道的醫療團隊。
在過去五年多以來,我們團隊總共收集了約1,213個相關胃腸道疾病的個案,這些臨床情況的適應症包括有:
1.頑固性腸躁症(尤其是以腹瀉、腹嗚、嚴重放屁為其主訴者);
2.一天中有三次或以上擾人的自覺性響屁出現者;
3.旅遊者腹瀉症的具體預防腹瀉者;
4.腹腔手術開刀後衍生腸沾黏,並伴隨著部份假性腸阻塞病症者(由於腸道蠕動不良,常是導致病原菌在腸阻塞前端過度滋長的病症);
5.胃幽門螺旋桿菌感染者在接受特定強效抗生素根除治療後衍生腹瀉,而需要補充特定益生菌者;
6.抗藥性胃幽門螺旋桿菌感染者;
7.結腸息肉或癌瘤在切除術後,益生菌灌注可以改善原有大腸內腸道菌群平衡的失調;
8.嚴重度脂肪肝伴隨肝功能異常者;
9.每天需要服用益生菌後,才能改善其所困擾的胃腸道症狀者;
10.頑固性胃食道逆流症候群罹患者;
11.某些無法以口服途徑攝取益生菌者;
12.高度懷疑存有小腸細菌過度生長(small intestinal bacterial overgrowth, SIBO)症候群者;
13.以益生菌做為肥胖者體重的管理者;
14.此外,為了其他因素而欲接受大腸內益生菌灌注的輔助治療的其他疾病人口群,則必先在專科醫師詳細的評估之下,才來決定其胃腸內灌注益生菌的需要性及其可行性;
15.五十歲以後,希望自身大腸腔內能再擁有一個全新健康穩定的「微生物生態環境」者13-16。
一種新興『胃腸內灌注益生菌』的臨床輔助治療經驗分享17-19
由實證醫學的研究與探討,顯示在以益生菌灌注做為臨床診治的實際效益上,胃腸內灌注益生菌的效應,顯然優勝於口服益生菌途徑的效果。由近些年來的眾多臨床實驗證實,益生菌在胃腸道疾病的臨床診治上,所扮演的角色已受到大多數臨床醫師的認同及其實踐,而胃腸內灌注益生菌的給與途徑才是首選方式。
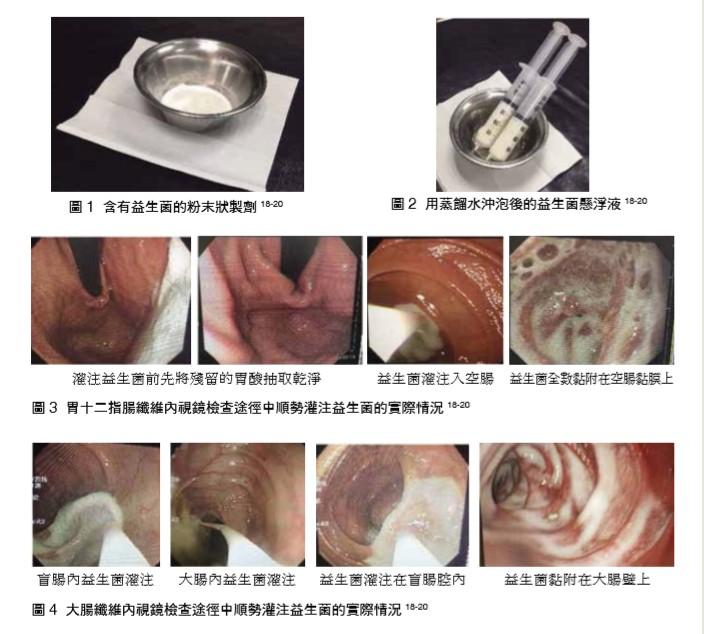
基本上,本團隊首先採取經由大腸纖維內視鏡檢查途徑中,將益生菌直接灌注入大腸管腔內後,其中使得存在於懸浮液中含有益生菌的微粒,會立即黏附在大腸黏膜上。因為益生菌經由口服方式途徑給與,難免會遭受到胃臟內強酸以及小腸內膽汁鹽及胰液的破壞,以致使其無法達成全數移植到大腸黏膜上的目的。
此外,由臨床實況圖片亦可知懸浮液的上清液在被吸走後,其中含有益生菌的微粒仍然固定置留在原位,由此亦顯示益生菌能安然定植在大腸上表皮層的佐証。
理論上,益生菌只有經由胃腸內灌注益生菌的給與途徑,才達到「足夠數量」來抗衡病原菌,亦即胃腸內益生菌灌注可以提升腸道內腸道菌群中益生菌的適當比例,並能在一時間使得益生菌/病原菌達到固有85:15(6:1)的壓倒性黃金比例。況且,由口服途徑益生菌服用劑量,更不可能跟灌注益生菌相提並論,灌注量/口服量之比可在30-60:1不等,但也因人因病況不同而異(圖1-5)
胃內視鏡灌注益生與大腸內視鏡灌注益生菌成效的比較
在本院過去所有曾經接受過胃腸灌注益生菌的1,213個個案中,進行一項前瞻性的世代研究(cohort study)臨床研究觀察。將其中資料完整的869個個案分為不同途徑來進行胃腸內灌注益生菌的三組。A組(122人)同時先後進行胃鏡十二指腸/空腸內與大腸鏡盲腸內灌注益生菌組。B組(355人)單獨進行胃鏡十二指腸/空腸內灌注益生菌組。C組(392人)單獨進行大腸鏡盲腸/升結腸內灌注益生菌組。並以治療者在接受灌注益生菌前後的主觀與客觀症狀與表徵,來做為分析比較其胃腸內灌注益生菌的效益。
結果:
一、三組個案在接受胃腸灌注益生菌後,都沒有發現有任何不良反應。
二、在這三組中,B組胃鏡灌注益生菌者的經濟成效較高於A組及C組(症狀緩解率80-90%)。
結論:
胃鏡內灌注益生菌並不亞於甚或更優於大腸內視鏡灌注益生菌的經濟效益(初報)。
討論與分析:
本團隊在近三年以來,開始經由胃十二指腸纖維內視鏡檢查途徑中,伸入空腸(十二指腸下端的小腸部分)腔內,進行灌注益生菌的臨床實務操作,並藉由小腸本身可較為快速的分節收縮及腸蠕動,再加上在灌注益生菌的步驟中,會更刺激小腸快速分泌大量pH偏鹼性(pH6-7.8)的小腸液(1-3公升/天),使得被灌注入的益生菌約在30-180分鐘(平均1-2小時)之內,可以快速輕易的到達迴腸末端20;但由於迴腸在與大腸盲腸交界處還有一道門閥即迴盲瓣(ileocecal valve),其主要功能是阻止小腸內容物過快地流入大腸內,而含有益生菌微粒的懸浮液在此廻腸與盲腸交界處也會被暫時緩慢下來,逗留些時候才再緩緩流出迴盲瓣出口並逐步流入盲腸內,而可安然到達其主要的繁殖場所的盲腸與升結腸黏膜上,而一旦益生菌流入盲腸內,其中所存留的糞便中不能被小腸液所消化的食物殘渣(粗纖維),也順勢被益生菌當做其食物來源,使得益生菌在腸道中順利進行分裂繁殖、生長、發育的主要任務(表1)。
基本上,大腸內視鏡檢查較胃內視鏡檢查有較高的風險及併發症,因此在醫師評估後,某些個體可以不一定需要經由大腸纖維內視鏡檢查途徑,來達到胃腸道內灌注益生菌介入性的給與。此外,在接受大腸纖維內視鏡檢查之前,接受益生菌灌注者都必須要先接受起碼兩天的低渣飲食,以及清腸劑的服用等複雜的術前準備工作,而這些都是受檢者都很不樂於接受的必要過程。因此,在近三年以來,團隊在進行直接經由胃、十二指腸纖維内視鏡檢查的途徑中,直接由胃內視鏡方式在小腸空腸內腔來灌注益生菌,不僅可由此繞道胃、十二指腸,使得益生菌完全不受胃酸及膽汁酸的侵襲與破壞,並可將益生菌順勢全數灌注入空腸內,如此一來更使得被檢查者樂於接受。
因此,由臨床實務經驗中亦可得知以胃內鏡操作來灌注益生菌進入空腸腔內,其成效並不亞於大腸鏡灌注益生菌的實際意義。換言之,胃鏡內灌注益生菌更是一項快速、簡易、方便、安全、省時、省事、省力更省錢,風險性較低的首選益生菌胃腸道灌注的新興方法(表1)。

結語與未來展望
腸道菌群是多樣化的,不同益生菌菌株的特異性及其生理功能也不一樣,單一益生菌的攝取是不足以扮演好益生菌應有的角色,不同屬種的益生菌則有相輔相成的成效,過多的益生菌則會互相競爭及互相排斥,如何才稱之為「適度足量」益生菌的口服攝取量或胃腸內益生菌灌注量?在初期口服益生菌攝取是否亦需要先給與足夠劑量的負荷劑量(loading dose) ,才能盡快達到或持續體內益生菌應有的治療效果濃度?胃腸內灌注益生菌何時需要再次追加?如何「養菌」?益生元(probiotics)的重要性?,以上種種都是臨床醫師所急欲了解的問題。由臨床實證醫學實務經驗探討,顯示外源性醫療用的益生菌可以經由胃腸內益生菌的灌注,可使『適當足夠』的益生菌,在迴避胃酸、膽汁酸及胰液,而繞道胃十二指腸而達到空腸的上端,以及含有益生菌顆粒可黏附在大腸黏膜上。
在不久的將來,期盼經由生物科技的進步,能夠在體外環境培養出對腸道更有特異性的益生菌菌株,使得益生菌更能展現出其對人類健康固有的益處,並進一步由此解開益生菌的神祕面紗。
參考文獻
1.Food and Agriculture Organization of the United Nations and World Health Organization. 2001, posting date. Regulatory and clinical aspects of dairy probiotics. Food and Agriculture Organization of the United Nations and World Health Organization Expert Consultation Report. Food and Agriculture Organization of the United Nations and World Health Organization Working Group Report(Online).
2.Barko PC, McMichael MA, Swanson KS, et al: The Gastrointestinal Microbiome: A Review. J Vet Intern Med 2018; 32: 9–25.
3.Bertazzoni ME, Benini A: Relationship between number of bacteria and their probiotic effects. Microb Ecol Health Dis 2008; 20: 180-3.
4. Mary Ellen Sanders: Probiotics and microbiota composition. BMC Med 2016; 14: 82-5.
5.Bezkorovainy A. Probiotics: determinants of survival and growth in the gut. Am J Clin Nutr 2001;73(2 Suppl):399S-405S.
6.Ciorba MA: A Gastroenterologist’s Guide to Probiotics. Clin Gastroenterol Hepatol 2012; 10: 960–968.
7.Vijaya Kumar B, Vijayendra SV, Reddy OV: Trends in dairy and non-dairy probiotic products-a review. J Food Sci Technol 2015; 52: 6112-24.
8. Fuochi V, Petronio GP, Lissandrello E, et al: Evaluation of resistance to low pH and bile salts of human Lactobacillus spp. isolates. Int J Immunopathol Pharmacol 2015; 28: 426-33.
9.Lankaputhra WEV: Survival of Lactobacillus acidophilus and Bifidobacterium ssp. in the presence of acid and bile salts. Cult Dairy Prod J 1995; 30: 2–7.
10. Di Cerbo A, Palmieri B. Review: The market of probiotics. Pak J Pharm Sci 2015; 28: 2199-206.
11.Klaenhammer TR, Kullen MJ. Selection and design of probiotics. Int J Food Microbiol 1999; 50: 45-57.
12.Rossen NG, MacDonald JK, de Vries EM, at al: Fecal microbiota transplantation as novel therapy in gastroenterology: A systematic review. World J Gastroenterol 2015; 21: 5359-71.
13.Dylag K, Hubalewska-Mazgaj M, Surmiak M, et al: Probiotics in the mechanism of protection against gut inflammation and therapy of gastrointestinal disorders. Curr Pharm Des 2014; 207: 1149-55.
14.Islam SU: Clinical Uses of Probiotics. Medicine Baltimore 2016; 95: e2658.
15.Principi N, Cozzali R, Farinelli E, et al: Gut dysbiosis and irritable bowel syndrome: The potential role of probiotics. J Infect 2018; 76: 111-20.
16.Sachdev AH, Pimental M: Gastrointestinal bacterial overgrowth: pathogenesis and clinical significance. Ther Adv Chronic Dis 2013; 4 :223-31.
17.譚健民: 不同益生菌給與途徑的分析與探討~著重於一個醫師的順勢胃腸內灌注益生菌的前瞻式研究經驗的分享(初報),台北市醫師公會會刊,2017; 61: 40-46.
18. 譚健民: 益生菌在消化系統疾病診治上所扮演角色的今日觀,台北市醫師公會會刊,2016; 60: 31-40.
19.譚健民: 激躁性腸道症候群致病機制的今日觀〜著重於「內臟高敏威性」與「益生菌」相互關係的探討 台灣醫界 2018; 61: 55-60.
20.Kim SK. Small intestine transit time in the normal small bowel study. AJR 1968; 104: 522–24.